Abstrakt
XXI əsrdə nanotexnologiyaların inkişafı müasir elmi tərəqqinin əsas istiqamətlərindən birinə çevrilmişdir. Lakin onların geniş tətbiqi ciddi ekoloji problemlə müşayiət olunur: getdikcə artan miqdarda nanohissəciklər ətraf mühitə düşərək orada toplanır və canlı orqanizmlərlə qarşılıqlı təsirə girə bilir. Xüsusilə su ekosistemləri ilə sıx bağlı olan və su hövzələrinə düşən çirkləndiricilərin təsirinə məruz qalan su quşları daha həssas hesab olunur. Bu baxımdan, təqdim olunan tədqiqatın məqsədi ev qazlarının orqanlarında gümüş nanohissəciklərinin yığılmasını müəyyənləşdirmək və qaraciyər ilə bağırsaqlarda onlar tərəfindən induksiya olunan ultrastruktur dəyişiklikləri xarakterizə etmək olmuşdur. Təcrübədə quşlara 100 mkq/ml dozada sintez olunmuş gümüş nanohissəcikləri tətbiq edilmişdir. Fiksə edilmiş bağırsaq və qaraciyər nümunələrindən bloklar hazırlanmış, rənglənmiş kəsiklər işıq və elektron mikroskopları vasitəsilə tədqiq edilmişdir. In vivo şəraitdə bağırsağın müxtəlif qatlarında və qaraciyərdə aşkarlanan gümüş nanohissəciklərinin ölçüsü 10–13 nm olmuşdur. Müəyyən edilmişdir ki, nanohissəciklərin tətbiqindən sonra qazların bağırsaq və qaraciyərinin bütün qatlarında ultrastruktur səviyyəsində patoloji dəyişikliklər baş verir.
Əsas mətn
ВВЕДЕНИЕ
Развитие нанотехнологий в XXI веке стало одним из важнейших направлений научного прогресса. Наноматериалы широко применяются в медицине, фармакологии, сельском хозяйстве, текстильной промышленности, электронике, пищевой индустрии и в других отраслях [1]. Однако вместе с их массовым внедрением в производство возникает серьёзная экологическая проблема: всё большее количество наночастиц оказывается в окружающей среде, где они могут накапливаться и взаимодействовать с биосистемами [2]. В отличие от традиционных загрязнителей, наночастицы обладают высокой поверхностной активностью, значительной химической реакционной способностью и способностью проникать через клеточные мембраны, что делает их потенциально опасными даже при низких концентрациях для живых организмов [3].
Среди различных типов наночастиц особое внимание уделяется металлическим наночастицам, в частности серебра (AgNP). С одной стороны, они обладают выраженными антибактериальными свойствами, что объясняет их популярность в медицине и производстве [4]. С другой стороны, неконтролируемое поступление AgNP в экосистему может приводить к их аккумуляции в живых организмах и вызывать неблагоприятные патологические эффекты. Исследования последних лет показали, что наночастицы серебра способны проникать в ткани растений, беспозвоночных, рыб, и млекопитающих, вызывая нарушения на клеточном и органном уровнях [3, 5, 6, 7]. Зафиксированы изменения в системах антиоксидантной защиты, нарушение работы митохондрий, повреждения мембран, а также дестабилизация генетического материала. [8].
Наибольшее внимание в литературе уделено водным организмам и лабораторным животным. Так, показано, что наночастицы серебра накапливаются в печени и почках рыб, где вызывают выраженные структурные и функциональные нарушения [9]. Отмечены деструктивные изменения митохондрий, эндоплазматического ретикулума, а также нарушения в системе детоксикации гепатоцитов. Подобные результаты получены и в экспериментах на млекопитающих, где выявлено повреждение тканей печени, кишечника, лёгких и мозга после экспозиции к Ag-NP [10]. При этом наблюдается дозозависимый характер токсичности: при низких концентрациях возможна активация адаптивных механизмов, тогда как при повышенных дозах развиваются некротические процессы и апоптоз.
Несмотря на накопленные данные, влияние наночастиц серебра на птиц остаётся малоизученным. В то время как исследования на курах и индейках в основном сосредоточены на изменениях продуктивности и иммунного ответа [11], структурные повреждения органов и тканей, особенно на ультраструктурном уровне, изучены недостаточно. В то же время птицы играют важную роль в экосистемах, являясь не только биоиндикаторами загрязнения, но и частью трофических цепей, через которые токсиканты могут передаваться далее. Особенно это касается водоплавающих птиц, которые тесно связаны с водными экосистемами и подвержены воздействию загрязнителей, поступающих в воду [12].
Исследование ультраструктурных изменений, возникающих под действием наночастиц в тканях птиц, имеет двойное значение. Во-первых, оно позволяет понять механизмы токсического действия наночастиц на клеточном уровне: какие органеллы наиболее чувствительны, какие процессы нарушаются в первую очередь. Во-вторых, такие данные необходимы для оценки экологических рисков применения нанотехнологий и выработки стратегий по минимизации их негативного влияния на окружающую среду [13]. В связи с этим целью настоящего исследования является изучение накопления наночастиц серебра в органах домашних гусей (Anser anser dom.) и характеристика индуцируемых ими изменений на ультраструктурном уровне в таких органах, как печень и кишечник.
МАТЕРИАЛЫ И МЕТОДЫ
1. Экспериментальные животные.
В качестве модельного объекта использовали домашних гусей (Anser anser domesticus) в возрасте одного года. Всего в исследование было включено 22 особи, которые были разделены на две группы: контрольную (n=11) и экспериментальную (n=11). Животных содержали в контролируемых лабораторных условиях при одинаковом режиме питания и свободном доступе к воде.
2. Синтез и характеристика наночастиц.
Серебряные наночастицы синтезировали химическим методом. Морфология и структура частиц были охарактеризованы с использованием сканирующей электронной микроскопии (СЭМ), рентгенодифракционного анализа (РДА), трансмиссионной электронной микроскопии (ТЭМ) и рентгенофлуоресцентного анализа (РФА) [14].
3. Подготовка образцов наночастиц.
Для получения образцов, пригодных для ТЭМ анализа, синтезированные наночастицы диспергировали в этаноле при помощи ультразвуковой обработки. Полученную суспензию наносили на медные сетки с углеродным покрытием и высушивали при комнатной температуре.
4. Постановка эксперимента.
Птицам экспериментальной группы вводили суспензию серебряных наночастиц пер орально в дозе 100 мкг/мл (1 мл на кг массы тела). Через трое суток проводили эвтаназию и отбирали образцы печени и кишечника для ультраструктурного анализа. Перед эвтаназией гусей анестезировали комбинацией кетамина и диазепама (25 мг/кг и 7,5 мг/кг, соответственно) [15].
5. Световая и электронная микроскопия.
Биоптаты печени и кишечника фиксировали при +4 °C в течение суток в смеси, содержащей 2,5% глютаральдегид, 2,5% параформальдегид и 0,1% пикриновую кислоту на фосфатном буфере (pH = 7,4). Постфиксацию осуществляли в 1% растворе тетраоксида осмия и 1,5% растворе феррицианида калия на 0,1 М фосфатном буфере (pH = 7,4) в течение 1,5–2 ч. После обезвоживания материал заливали в эпоксидные смолы (Аралдит и Эпон-812) по стандартной методике [16]. Срезы готовили на ультрамикротоме EM UC7 (Leica). Полутонкие срезы (1–2 мкм) окрашивали по методике Морикава и др. (2018) и изучали под световым микроскопом Primo Star (Zeiss) [17]. Фотографировали окрашенные препараты под цифровой фотокамерой EOS D650 (Canon). Ультратонкие срезы (50–70 нм) окрашивали 2% водным раствором уранилацетата, затем 0,4% раствором цитрата свинца в 0,1 М растворе NaOH. Электронограмм окрашенных и неокрашенных препаратов получали на трансмиссионном электронном микроскопе JEM-1400 (Joel) при ускоряющем напряжении 80–120 кВ.
6. Этические аспекты.
Все манипуляции с животными выполняли в соответствии с Конвенцией Совета Европы о защите позвоночных животных, используемых для экспериментов и иных научных целей (Страсбург, 18 марта 1986 г.).
РЕЗУЛЬТАТЫ
1. Изменения в кишечнике.
На рисунке 1A представлены изображения полутонких срезов (1 мкм) тонкого кишечника гуся. Она состоит из серозного, многослойного мышечного, подслизистого и слизистого слоев (Рис. 1A). Одним из наиболее заметных моментов в гистологических срезах было нарушение целостности слизистого слоя в разных частях кишечника. Повреждения слизистой наблюдались преимущественно в областях, обращенных к просвету кишечника (Рис. 1A).
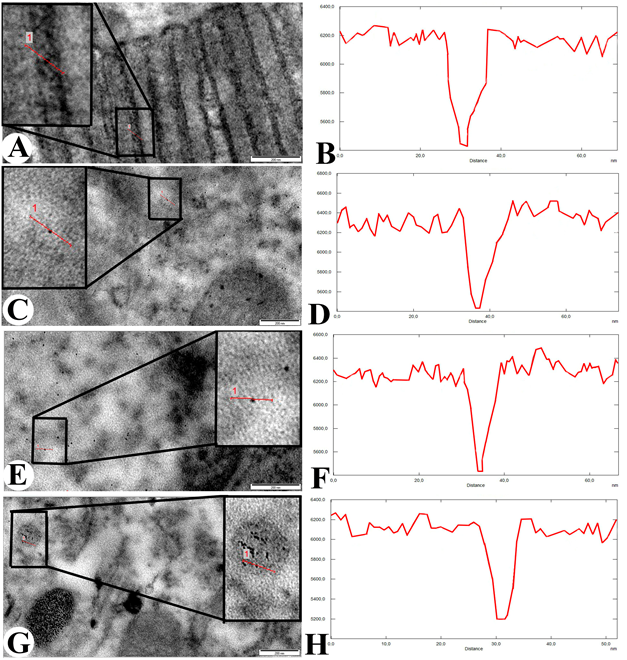
Электроннограммы, полученные с ультратонких срезов того же блока, показывает общий вид слизистого слоя (Рис. 1B). В левом углу изображения хорошо видны микроворсинки. С другой стороны, ворсинки были повреждены и разрушены, а поврежденные органеллы в цитоплазме эпителиальных клеток мигрировали в просвет. Между эпителиальными клетками и в их цитоплазме накапливался отёк. Патология наблюдалась и в ядрах эпителиальных клеток (Рис. 1B). На рисунке 1C, увеличенный вид эпителиального слоя показывает повреждение мембран микроворсинок и миграцию фрагментов цитоплазматических структур в просвет. В цитоплазме эпителиальных клеток образовались многочисленные прозрачные участки. Ультраструктурное исследование подслизистого слоя кишечной стенки выявило утолщение базальной мембраны и образование прозрачных областей. Отёк формировался в межклеточных пространствах и внутри цитоплазмы клеток (Рис.1D). В подслизистом слое, кроме соединительной ткани, наблюдалось множество кровеносных сосудов. Здесь структура эндотелиальных клеток, образующих стенку сосуда с эритроцитами в просвете, была повреждена и фрагментирована. Мембраны клеток эндотелия не были видны, а цитоплазматические структуры отсутствовали (Рис. 1E). На рисунке 1F показан сосуд с эритроцитной клеткой в просвете. В отличие от предыдущего сосуда, эндотелиальные структуры (ядро и цитоплазма) присутствовали, но проницаемость сосуда увеличилась. В результате в периваскулярных пространствах накапливался отёк (Рис. 1F). Также наблюдались изменения в эритроците в просвете сосуда: нарушалась связь между ядерной оболочкой и цитоплазмой. На рисунке 2A показано поглощение и биоаккумуляция наночастиц серебра. Они визуально обнаружены на мембранах и внутри ворсинок кишечника домашних птиц. Определено, что размер наночастиц составлял 12 нм (Рис. 2B). Помимо микроворсинок, наночастицы также обнаружены в цитоплазме эпителиальной клетки (Рис. 2C). Здесь их размер составлял 12 нм (Рис. 2D). Большое количество наночастиц также обнаружено внутри ядра, расположенного в центре цитоплазмы эпителиальной клетки (Рис. 2E). Их размер состолял 10 нм (Рис. 2F). Помимо цитоплазмы и ядра, наночастицы наблюдались и в других органеллах, включая лизосомы. В отличие от других органелл, в лизосомах наночастицы встречались в виде агломератов (Рис.2G). Их размер составлял 10 нм (Рис.2H).
2. Изменения в печени
На рисунке 3A представлены образцы печени контрольной группы птиц. Здесь были отчетливо видны гепатоциты, их ядра и синусоиды между клетками печени. Рисунок 3B показывает изображения печени, подвергшейся воздействию наночастиц серебра, где уже наблюдается серьезные патологические изменения. Границы между гепатоцитами не различались, а в их цитоплазме образовались аморфные прозрачные участки. Кроме того, было установлено, что ткани печени, подвергшиеся воздействию наночастиц, в основном окрашивались в розовый цвет (Рис. 3B).
Электронограммы структурных элементов печени (Рис. 3C), показывают несколько гепатоцитов и окружающие их кровеносные сосуды (синусоиды). В просвете синусоида в верхнем левом углу обнаружена эритроцит с ядром. Ядро разрушено, и связь с цитоплазмой эритроцита полностью нарушена. Также в цитоплазме эритроцита образовались крупные и мелкие прозрачные структуры (вероятно, вакуоли). Расстояние между гепатоцитами увеличилось (Рис. 3C). При изучении самого гепатоцита было отмечено, что гликоген, распределенный неравномерно, перешел в аморфное состояние, образуя прозрачные участки (Рис. 3D). Количество других органелл в цитоплазме гепатоцита резко уменьшилось, произошли изменения в мембранах митохондрий - их кристы неразличимы. Хроматин в ядре распределен неравномерно. Межклеточные контакты между гепатоцитами нарушены, что привело к резкому увеличению расстояния между клетками. Количество лизосом в цитоплазме увеличилось, и внутри них прослеживается биоаккумулирование наночастиц (Рис. 3D). В синусоидах наблюдалось повреждение мембран эндотелиальных клеток, формирующих их стенки, с разрывами в некоторых местах. В результате повысилась проницаемость сосудов и жидкость отека проникла в пространство Диссе. Помимо образования многочисленных вакуолей в цитоплазме эндотелия, были обнаружены темные структуры (тела). Фрагменты эндотелиальных клеток также наблюдались в просвете синусоидов (Рис. 3E). Мембраны микроворсинок, направленных в просвет желчных капилляров, были разрушены, некоторые полностью. Плотные контакты между гепатоцитами и желчными капиллярами нарушены или отсутствуют (Рис.3F). Электронограммы показали значительное биоаккумулирование наночастиц серебра в эритроцитах (Рис. 4A). Размер наночастиц составлял 11 нм (Рис. 4B). Наночастицы также обнаружены в цитоплазме эндотелиальных клеток стенок сосудов (Рис. 4C), с размером 11 нм (Рис. 4D). Аккумулирование наночастиц визуально наблюдалось и в пространстве Диссе (Рис. 4E), размером 13 нм (Рис. 4F). Наночастицы отмечены в цитоплазме гепатоцитов, митохондриях и лизосомах (Рис. 4G–H), а также в просвете желчных капилляров и внутри микроворсинок (Рис. 4I–J), размером 13 нм.
ДИСКУССИЯ
Информации о влиянии Ag наночастиц на организм птиц, включая кишечник, очень мало [18, 19]. В целом известно, что адсорбция наночастиц организмом хозяина через органы пищеварения осуществляется энтероцитами, которые выполняют барьерную функцию в стенке кишечника [20]. Механизм проникновения наночастиц включает парацеллюлярный и трансцеллюлярный пути: частицы проходят в цитоплазму эпителиальных клеток с ворсинками, обращёнными в просвет кишечника, а затем мигрируют в сосуды подслизистого слоя. Мы наблюдали эти механизмы при электронно-микроскопическом исследовании кишечника домашних птиц, после введения наночастиц серебра (см. Рис 1-2). Данных о влиянии Ag наночастиц на кишечник птиц с использованием ТЭМ ранее не встречалось. Гистологически патология в микроворсинках энтероцитов и их цитоплазме у цыплят-бройлеров после воздействия Ag наночастиц не наблюдалась; отмечалось лишь истончение базального слоя и формирование небольших вакуолей [18]. Другое исследование указывает на положительное влияние добавления наночастиц в корм на развитие кишечной микрофлоры, продуктивность и иммунный ответ хозяев [19]. С учётом вышеизложенного, было целесообразно сопоставить изменения, вызываемые наночастицами в кишечнике других позвоночных, с результатами, полученными с помощью ТЭМ и частично гистологических методов. У карпа наблюдались некроз и частичная дегенерация клеток слизистой кишечника под действием наночастиц серебра [21, 22]. У Ameca splendens при воздействии наночастиц серебра отмечались следующие изменения: отделение эпителия от слизистой поверхности, выявление лимфоцитов, эозинофилов и макрофагов в слизистом слое, истончение слизистой по сравнению с контролем и увеличение числа макрофагов в подслизистом слое [23]. При воздействии Fe3O4 наночастиц на карпа отмечены разрушение целостности энтероцитов в слизистом слое, повреждение структуры микроворсинок, выход цитоплазматических элементов в просвет, изменения активности эпителиальных клеток, превращение вакуолей и мембранных структур подслизистого слоя в миелиноподобные тела, повышенная проницаемость сосудов и повреждение эндотелиальных клеток [6]. При воздействии Fe3O4 на радужную форель патологические изменения в тонком кишечнике были менее выражены: увеличилось число деформированных энтероцитов и мононуклеарных клеток с прозрачными зонами, уменьшилось число микроворсинок на апикальной поверхности, образовались миелиноподобные структуры вокруг ворсинок и нарушена целостность фосфолипидного слоя мембран [1]. После воздействия токсичных Ag наночастиц у домашних птиц, наблюдались аналогичные патологии в тонком кишечнике. Изменения в цитоплазме ворсинок апикальной части энтероцитов, самих энтероцитов и подслизистого слоя были почти идентичны. Следует учитывать тип, концентрацию и продолжительность использования наночастиц, а также их размер. Так, максимальный размер мигрирующих Fe наночастиц в кишечнике карпа составлял 20 нм [6], а размер Ag наночастиц у цыплят-бройлеров - 15 нм [18]. В другом исследовании размер накопившихся в кишечнике человека Ag наночастиц составил 10–20 нм [24]. В наших исследованиях размер наночастиц серебра, накапливающихся в различных слоях кишечника и мигрирующих в эритроциты просвета сосудов подслизистого слоя, составил 10–12 нм. Сравнение с литературными данными показало, что размер наночастиц не превышал 20 нм [1, 6].
Существуют исследования, посвящённые влиянию различных металлических наночастиц, включая серебро, на печень позвоночных, включая птиц [9, 18, 25-32]. Анализ этих данных показывает, что серебро оказывают токсическое воздействие на печень птиц, вызывая серьёзные патологические изменения в структурных элементах паренхимы. Сравнение результатов настоящего исследования с литературными данными выявляет сходство патологий как на гистологическом, так и на электронно-микроскопическом уровне. Разнообразие выявленных патологий зависит от использованной концентрации. В наших экспериментах доза составляла 100 мкг/мл, тогда как в других исследованиях применялись 2–8 мг/кг [30], 150 мкг/кг [18] и 2,5–20 мг/кг [29]. Таким образом, используемая нами концентрация считается низкой по сравнению с другими.
Информации о бионакоплении и визуальной регистрации наночастиц в печени немного [1, 9]. Единственный источник, посвящённый именно наночастицам серебра, показал их накопление в цитоплазме гепатоцитов мышей, внутри ядра и в различных органеллах [27]. В нашем исследовании, помимо накопления в гепатоцитах и органеллах их цитоплазмы, наночастицы обнаруживались в эритроцитах в синусоидах между печёночными клетками, в цитоплазме эндотелия, образующего стенку сосудов, в пространстве Диссе между гепатоцитами и сосудами, а также в желчных капиллярах. Некоторые источники сообщают, что размер наночастиц в печени составляло до 20 нм [9]. В нашем исследовании при анализе электронограмм, их размеры составляли 11–13 нм. Механизм миграции и усвоения Ag наночастиц в печени домашних птиц, также был уточнён: поподая в цитоплазму эритроцитов сосудов подслизистого слоя кишечника, наночастицы далее мигрировали в сосуды печени, через стенку синусоидов - в пространство Диссе, а затем в гепатоциты и их органеллы. Часть наночастиц поглощалась лизосомами и выводилась из клеток, часть - попадала в желчные капилляры, а затем в желчные протоки и выводилась из организма. Показано, что бионакопление и миграция наночастиц оксида железа в печени рыб происходят аналогичным образом [1, 9].
ЗАКЛЮЧЕНИЕ
В условиях in vivo, наночастицы серебра, обнаруженные в структурных элементах разных слоев тонкого кишечника птиц, имели размер - от 10 до 12 нм. Наночастицы проходили через мембраны тонкой кишки домашних гусей, попадали в цитоплазму эпителиальных клеток, затем мигрировали в эндотелий сосудов подслизистого слоя и далее в цитоплазму эритроцитов в просвете, где биоаккумулировались и перемещались в другие органы и ткани. Было выявлено, что размер биоаккумулированих частиц в различных структурных компонентах печени (эритроциты в просвете синусоидов, эндотелиальные стенки, пространство Диссе, цитоплазма и органеллы гепатоцитов, стенки и просвет желчных капилляров) составляет 11–13 нм. Таким образом, после введения наночастиц птицам наблюдались патологические изменения в ультраструктурных элементах печени и кишечника.
Şəkillər

Açar sözlər
İstinadlar
1. Agayeva N.J., Rzayev F.H., Gasimov E.K., Mamedov Ch.A., Ahmadov I.S., Sadigova N.A., Khusro A., Abdullah Al-Dhabi N., Arasu M.V. Exposure of rainbow trout (Oncorhynchus mykiss) to magnetite (Fe3O4) nanoparticles in simplified food chain: Study on ultra-structural characterization // Saudi J. Biol. Sci., 2020, 27(12), 3258-3266. https://doi.org/10.1016/j.sjbs.2020.09.032
2. Hassanen E.I., Hussien A.M., Mehanna S., Morsy S.A. Chitosan coating silver nanoparticles as a promising feed additive in broilers chicken // BMC Vet Res., 2023, 19(1), 265. doi: 10.1186/s12917-023-03826-7.
3. Rzayev F.H., Gasimov E.K., Agayeva N.J., Manafov A.A., Mamedov C.A., Ahmadov I.S., Khusro A., Arasu M.V., Sahibzada M.U.K., Al-Dhabi N.A., Choi K.C. Microscopic characterization of bioaccumulated aluminium nanoparticles in simplified food chain of aquatic ecosystem // J. King Saud Univ. Sci., 2022, 34, 1-8. https://doi.org/10.1016/j.jksus.2021.101666
4. Mahmoud W.M., Abdelmoneim T.S., Elazzazy A.M. The Impact of Silver Nanoparticles Produced by Bacillus pumilus As Antimicrobial and Nematicide // Front. Microbiol., 2016, 7, 1746. https://doi.org/10.3389/fmicb.2016.01746
5. Ahmadov I.S., Gasimov E.K., Sadiqova N.A., Agayeva N.J., Rzayev F.H., Manafov A.A. Transfer of nanoparticles in a simplified aquatic food chain: from water plant Elodea canadensis to molluscs Lymnaea auricularia // J. Low. Dimens. Syst., 2018, 2(2), 41-45.
6. Hajiyeva A., Mamedov Ch., Gasimov E., Rzayev F., Khalilov R., Ahmadian E., Eftehari A., Cho W.C. Ultrastructural characteristics of the accumulation of iron nanoparticles in the intestine of Cyprinus carpio (Linnaeus, 1758) under aquaculture // Ecotoxicol. Environ. Saf., 2023, 264, 1-12. https://doi.org/10.1016/j.ecoenv.2023.115477
7. Nasirov A.M., Rzayev F.H., Seyidli Y.M., Gasimov E.K., Bunyatova K.I., Ibrahimova N.E., Seyidbeyli M.I. The Effect of ZnO Nanoparticles to Paradilepis scolicina Rudolphi, 1819 (Cyclophyllidea: Dilepididae) Cestode Observed First in Common Carp (Cyprinus carpio L., 1758) in Azerbaijan // Egyp. J. Vet. Sci., 2024, 55(1), 83-99. https://dx.doi.org/10.21608/ejvs.2023.224849.1547
8. Rekik Y., Suárez V.T., Sharma V.R., Chevallet M., Gallet B., Falconet D., Charbonnier P., Kieffer I., Tucoulou R., Jouneau P.H., Veronesi G. Deciphering silver nanoparticle fate in liver up to biliary excretion using HepG2/C3A spheroids in scenarios mimicking different exposure pathways // Environ. Sci.: Nano, 2023,10, 1842-1857. https://doi.org/10.1039/D3EN00177F
9. Hajiyeva A., Mamedov Ch., Gasimov E., Rzayev F., Isayev O., Khalilov R., Eftekhari A., Benis K.Z. Ultrastructural investigation of iron oxide nanoparticles accumulation in the liver of common carp (Cyprinus carpio Linnaeus, 1758) // Aquat. Toxicol., 2024, 272, 1-12. https://doi.org/10.1016/j.aquatox.2024.106961
10. Brandts I., Cánovas M., Tvarijonaviciute A., Llorca M., Vega A., Farré M., Pastor J., Roher N., Teles, M. Nanoplastics are bioaccumulated in fish liver and muscle and cause DNA damage after a chronic exposure // Environ. Res., 2022, 212, p.113433. https://doi.org/10.1016/j.envres.2022.113433
11. Vadalasetty K.P., Lauridsen C., Engberg R.M., Vadalasetty R., Kutwin M., Chwalibog A., Sawosz E. Influence of silver nanoparticles on growth and health of broiler chickens after infection with Campylobacter jejuni // BMC Vet Res., 2018, 2;14(1):1. doi: 10.1186/s12917-017-1323-x.
12. Mahini M., Arabameri S. Ashayerizadeh O., Ansari M., Samadi F. In ovo injection of silver nanoparticles modulates some productive traits and hepatic gene expression of broilers exposed to lipopolysaccharide challenge // Biotech., 2023, 13(6):197. doi: 10.1007/s13205-023-03627-7
13. Zaoui Y., Belanche A., Ben-Jeddou K., Jimenez M.S., Fondevila G., Fondevila M. Effect of the dietary administration pattern of silver nanoparticles on growth performance, biodiversity of digestive microbiota and tissue retention in broiler chickens // Anim Feed Sci Technol., 2024, 309, p.115888. https://doi.org/10.1016/j.anifeedsci.2024.115888
14. Hajiyeva S., Hasanova U., Gakhramanova Z., Israyılova A., Ganbarov K., Gasımov E., Rzayev F,. Eyvazova G., Huseynzada A., Alıyeva G., Hasanova I., Maharramov A. The role of diazacrown ether in the enhancement of the biological activity of silver nanoparticles // Turk. J. Chem., 2019, 43, 1711-1721. https://doi.org/10.3906/kim-1907-10
15. Lierz M., Korbel R. Anesthesia and analgesia in birds // J. Exot. Pet. Med., 2012, 21, 44-58. https://doi.org/10.1053/j.jepm.2011.11.008
16. Kuo J. Electron microscopy: methods and protocols // Totowa: Humana Press, 2014, 799 p. doi:10.1007/978-1-62703-776-1
17. Morikawa Sh., Sato A., Ezaki T. A simple, one-step polychromatic staining method for epoxy-embedded semithin tissue sections // Microscopy, 2018, 67(6), 331-344 https://doi.org/10.1093/jmicro/dfy037
18. Salem H.M., Ismael E., Shaalan M. Evaluation of the Effects of Silver Nanoparticles Against Experimentally Induced Necrotic Enteritis in Broiler Chickens // Int. J. Nanomed., 2021, 16, 6783-6796. https://doi.org/10.2147/IJN.S319708
19. Michalak I., Dziergowska K., Alagawany M., Farag M.R., El-Shall N.A., Tuli H.S., Emran T.B., Dhama K. The effect of metal-containing nanoparticles on the health, performance and production of livestock animals and poultry // Vet. Q., 2022, 42(1), 68-94. https://doi.org/10.1080/01652176.2022.2073399
20. Vitulo M., Gnodi E., Meneveri R., Barisani D. Interactions between Nanoparticles and Intestine // Int. J. Mol. Sci., 2022, 23, 4339. https://doi.org/10.3390/ijms23084339
21. Kakakhel M.A., Wu F., Feng H., Hassan Z., Ali I., Saif I., Din S.Z.U., Wang W. Biological synthesis of silver nanoparticles using animal blood, their preventive efficiency of bacterial species, and ecotoxicity in common carp fish // Microsc. Res. Tech., 2021, 84(8), 1765-1774. https://doi.org/10.1002/jemt.23733
22. Kakakhel M.A., Wu F., Sajjad W., Zhang Q., Khan I., Ullah K., Wang W. Long-term exposure to high-concentration silver nanoparticles induced toxicity, fatality, bioaccumulation, and histological alteration in fish (Cyprinus carpio) // Environ. Sci. Eur., 2021, 33, 1-11. https://doi.org/10.1186/s12302-021-00453-7
23. Kamaszewski M., Kawalski K., Wiechetek W., Szudrowicz H., Martynow J., Adamek-Urbanska D., Losiewicz B., Szczepanski A., Bujarski P., Frankowska-Lukawska J., Chwascinski A., Aksakal E. The Effect of Silver anoparticles on the Digestive System, Gonad Morphology, and Physiology of Butterfly Splitfin (Ameca splendens) // Int. J. Mol. Sci., 2023, 24, 1-19. https://doi.org/10.3390/ijms241914598
24. Gokulan K., Williams K., Orr S., Khare S. Human Intestinal Tissue Explant Exposure to Silver Nanoparticles Reveals Sex Dependent Alterationsin Inflammatory Responses and Epithelial Cell Permeability // Int. J. Mol. Sci., 2021, 22, 9. https://doi.org/10.3390/ijms22010009
25. Al-Doaiss A., Jarrar Q., Moshawih S. Hepatic histopathological and ultrastructural alterations induced by 10 nm silver nanoparticles // IET Nanobiotechnol., 2020, 14(5), 405-411. https://doi.org/10.1049/iet-nbt.2020.0039
26. Almansour M., Sajti L., Melhim W., Jarrar B.M. Ultrastructural hepatocytic alterations induced by silver nanoparticle toxicity // Ultrastruct. Pathol., 2016, 40(2), – p. 92-100. https://doi.org/10.3109/01913123.2016.1150377
27. El-Habit O.H., Mousa E.A., Hassan B.N. Cytotoxicity of Silver Nanoparticles in Mice Liver Cells: An Ultrastructure Study // Egypt. J. Hosp. Med., 2014, 57, 554-564. doi:10.12816/0008488
28. Al-Qadhely A.Y., Al-baker A.A. Study of Histopathological Changes of Silver Nanoparticles in Liver of Coturnix Bird // HIV Nursing, 2022, 22(2), 1549-1552.
29. Al-Sultan S.I., Hereba A.R.T., Hassanein K.M.A., Abd-Allah S.M.S., Mahmoud U.T., Abdel-Raheem S.M. The impact of dietary inclusion of silver nanoparticles on growth performance, intestinal morphology, caecal microflora, carcass traits and blood parameters of broiler chickens // Ital. J. Anim. Sci., 2022, 21(1), 967-978. https://doi.org/10.1080/1828051X.2022.2083528
30. Dosoky W.M., Fouda M.M.G., Alwan A.B., Abdelsalam N.R., Taha A.E., Ghareeb R.Y., El-Aassar M.R., Khafaga A.F. Dietary supplementation of silver‑silica nanoparticles promotes histological, immunological, ultrastructural, and performance parameters of broiler chickens // Sci. Rep., 2021, 11, 4166, 1-15. https://doi.org/10.1038/s41598-021-83753-5
31. Loghman A., Iraj S.H., Naghi D.A., Pejman M. Histopathologic and apoptotic effect of nanosilver in liver of broiler chickens // Afr. J. Biotechnol., 2012, 11(22), 6207-6211. https://doi.org/10.5897/AJB11.1768
32. Tavakoli R., Hashemi S.R., Davoodi D., Jafari Y., Hassani S. Histopathologic investigation of liver and kidney tissues in broiler chickens fed silver nanoparticles coated on zeolite // J. Anim. Sci. Res., 2020, 30(2), 15-23. https://doi.org/10.22034/as.2020.11450
Məqalə barədə təfərrüatlar:
Nəşr tarixçəsi
Dərc edilib: 26.Nov.2025
Müəllif hüququ
© 2022-2025. Azərbaycan Tibb Universitetinin nəşri. Jurnalın elektron versiyası "Uptodate in Medicine" tibb nəşriyyatı tərəfindən dərc olunur. Bütün hüquqlar qorunur.Əlaqəli məqalələr
Baxılıb: 977



