Abstract
Abstrakt: The given article talks about the disruption of the free radical-antioxidant balance as the result of oxidation-reduction reactions in the body under the influence of toxic substances, and the creation of oxidative stress resulting from the accumulation of excess free radicals. It also mentions the need for taking external antioxidants in order to protect the body tissues from the effects of free radicals. The paper describes the tests used to measure the antioxidant activity of biologically active substances (ORAC, HORAC, TRAP, CUPRAC, FRAP, Folin-Ciocalto, ABTS (TEAC) and DPPH tests), as well as the methods and essence of those tests.
Full article
GİRİŞ
Oksigen həyat üçün vacib elementdir. Hüceyrələrin enerji əldə etmək üçün mitoxondrilərdə ATF istehsalı prosesində oksigen sərf etdikləri zaman sərbəst radikallar yaranır. Sərbəst radikallar hüceyrə oksidləşmə-reduksiya reaksiyaları nəticəsində yaranan oksigen (ROS – Reactive Oxygen Species) və azotun (RNS – Reactive NitrogenSpecies) fəal formalarıdır. Sərbəst radikallar orqanizmdə ikili rol oynayırlar, yəni eyni zamanda həm toksik və həm də qoruyucu təsir göstərirlər. Onlar orqanizmin sağlamlığını təmin edən bir çox zəruri funksiyalara malikdirlər. Belə funksiyalara hüceyrələrin mayalanması və inkişafı, prostoqlandinlərin və nuklein turşularının biosintezi, toksik məhsulların orqanizmdən uzaqlaşdırılması, bakteriya, virus, şiş hüceyrələrindən qorunma və s. aid edilə bilər. Sərbəst radikal olan oksigenin fəal forması “toxuma tənəffüsü” kimi xarakterizə olunan hüceyrələrin normal metbolizminintəmin olunmasında mühüm əhəmiyyətə malikdir. Normal aerob metabolizm və ya bakteriya və virus hücumu zamanı,həmçinin ksenobiotiklərin metabolizmində faqositlərin oksidləşdirici aktivləşməsi baş verərkən hüceyrələr tərəfindən oksidləşdiricilər istehsal olunur, beləliklə orqanizmin müdafiəsi təmin olunur.
Lakin sərbəst radikalların orqanizmdə normadan artıq miqdarda yaranması toxuma zədələnməsi, iltihab və neyrodegenerativ xəstəliklər kimi müxtəlif patoloji proseslərin əmələ gəlməsinəgətirib çıxarır. Normadan artıq yaranmış sərbəst radikallar orqanizmdə sərbəst radikal – antioksidant tarazlığının pozulmasına səbəb olur və nəticədə oksidativ stress əmələ gəlir. Oksidativ stress isə lipid, zülal, nuklein turşuları kimi vacib molekulların geri dönməz zədələnmələrinə səbəb ola bilər. Hüceyrələrdə oksigen metabolizmə uğrayaraq oksigenin potensial zərərli təsirə malik aktiv formalarına çevrilir. Proseslərin normal vəziyyətlərində oksidləşdiricilərin yaranma sürəti və amplitudası onların xaricolma sürətləri ilə tarazlaşdırılır. Lakin prooksidant və antioksidant tarazlığı pozulduqda ROS-un bioloji hüceyrələrdə artıq miqdarının toplanılması baş verir və oksidativ stress inkişaf edir. Oksidativ stress nəticəsində yaranan ROS-un aktiv məhsulları – hidrogen peroksid və hidroperoksidlər orqanizmin antioksidant müdafiə gücünü tükədərək lipidlərin peroksid oksidləşməsini stimullaşdırır, hüceyrə membranının tamlığını pozur və nuklein turşularını (DNT və RNT) oksidləşdirir ki, nəticədə hüceyrə ciddi zədə alır. Xərçəngin müxtəlif növləri, diabet, arterial hipertenziya, ateroskleroz, DNT kodunda dəyişiklik, kəskin böyrək çatışmazlığı, Alsheymer, Parkinson, xora, artrit, kardiovaskularvə s. xəstəliklərin yaranma səbəbi kimi sərbəst radikalların zərərli təsiri göstərilir. Həmçinin, sərbəst radikalların orqanizmdə tədricən toplanılması qocalma prosesinin sürətlənməsinə səbəb olur. Müxtəlif toxumalarda, o cümlədən beyin, ürək və qanyaradıcı orqanların toxumalarında iltihabi proseslər sürətlənir.
SƏRBƏST RADİKALLAR
Sərbəst radikallar xarici elektron təbəqəsində bir və ya bir neçə cütləşməmiş elektrona malik kimyəvi hissəciklərdir. Radikallarda cütləşməmiş elektron nöqtə (●) ilə işarə olunur. ROS sərbəst radikallara hidroksil (OH●), superoksid (O2●-), peroksid (ROO●), alkoksid (RO●), hidroperoksid (HO2●) və lipid peroksid (ROO●) aid edilir.RNS sərbəst radikallara isə azot oksid (NO●), azot dioksid (NO2●) aiddir. Bununla yanaşı, hidrogen peroksid (H2O2), ozon (O3), sinqlet oksigen (1O2), hipoxlorit turşusu (HOCl), nitrit turşusu (HNO2), peroksinitrit (ONOO-), nitrit xlorid (NO2Cl), diazot trioksid (N2O3), lipid peroksid (LOOH) sərbəst radikal deyildir və ümumi şəkildə oksidləşdirici adlanırlar, lakin canlı orqanzimdə asanlıqla sərbəst radikal əmələ gətirməyə qadirdirlər [1]. Xarici təbəqəsində cütləşmiş elektrona malik atomlar stabil olurlar, lakin cütləşməmiş elektronlu atomlar, yəni xarici elektron orbitallarında tək elektronları olan atomlar qeyri-stabil və reaksiyaya həris olurlar. Belə atomlar çatmayan elektronlarını bərpa etmək üçün qonşu qeyri-radikal atomların elektronlarını ya mənimsəyirlər və yaxud xarici təbəqədəki tək elektronunuonlara ötürməklə özlərinistabilləşdirirlər. Proses orqanizmdə baş verdiyi üçün qonşu atom canlı toxuma ola bilər və belə halda toxuma, öz elektronunun sərbəst radikal ilə mübadiləsindənsonra zədələnir. Sonra həmin toxuma molekulu öz stabilliyini təmin etmək üçün digər qonşu molekul ilə elektron mübadiləsi edir, özündə çatmayan elektronu qonşu toxumadan, məs., hüceyrə membranının ikiqat təbəqəsində olan molekuldanqoparmağa və ya öz artıq elektronunu qonşu molekulaötürməyə çalışır. Nəticədə ikincili sərbəst radikal yaranır və beləliklə, toxuma molekullarının zəncirvari zədələnməsi davam edir. Proses uzunmüddətli olduqda oksidativ stress inkişaf edir, məruz qalan hüceyrələrin tamlığı pozulur və sonda həmin hüceyrələr məhv olurlar.
Sərbəst radikallar orqanizmdə daxili (təbii) və xarici (yad) olmaqla iki yolla əmələ gəlirlər [2]. Orqanizm daxilində ROS və RNS kimi sərbəst radikalların yaranması hüceyrə fəaliyyəti və təbii maddələr mübadiləsi nəticəsində baş verir. Hüceyrələrdə sərbəst radikallar fermentativ və qeyri-fermentativ reaksiyalarla yarana bilərlər. Müxtəlif funksiyalara malik hüceyrələrin həyat fəaliyyətində oksidləşmə-reduksiya reaksiyaları mühüm əhəmiyyətə malikdir və bu reaksiyalar nəticəsində artıq miqdarda sərbəst radikalların yaranması müşahidə oluna bilər.Hüceyrə sistemləri (NADPH, ksantinoksidaza, Sitoxrom P450 fermentləri) sərbəst radikallar yarada bilərlər (Şək. 1). Əksər məməlilərin hüceyrələrində sərbəst radikal xassəli reaktiv oksigenin müxtəlif formalarının yaranması mitoxondrilərdəbaş verir [3].
Sərbəst radikalların orqanizmdə yaranmasında digər yol isə xarici mühit amillərinin təsirindən baş verən prosesdir. Tütün tüstüsünə, rentgen şüalarına, mikrodalğa şüalanmasına, vulkan qazlarına, zərərli qazlara (xlorofrom, xlorlu törəmələr), radioaktiv şüalanmaya, kosmetik vasitələrə, meşə yanğınlarına, alkoqoldan mütamadi və çox istifadəyə, bəzi dərman preparatlarının qəbuluna, günəş şüalarının zərərli təsirinə məruzqalma nəticəsində orqanizmdə sərbəst radikalların artıq miqdarda toplanılması baş verir. Həmçinin, sərbəst radikalların toplanılmasına qidaya konservant kimi əlavə edilmiş kanserogen maddələr (nitritlər, nitratlar), bitki yağlarının həddən artıq qızdırılması nəticəsində yaranan peroksid və politsiklik aromatik karbohidrogenlər də səbəb ola bilər.
Sərbəst radikalların yaranmasında ksenobiotiklərin rolu böyükdür. Ksenobiotiklərin metabolizmi zamanı orqanzimi onların zərərli təsirindən qorumaq üçün qaraciyərdə gedən detoksikasiya prosesində qlütation (GSH) aktivfəaliyyət göstərir, ksenobiotiklərlə birləşərək onların orqanzimdən uzaqlaşmasını təmin edir. Bu prosesə GSH-ın çox hissəsi sərf olunaraq tükənir və antioksidant fəaliyyətini yerinə yetirmək üçün onun miqdarı kifayət etmir. GSH-ın iki növü vardır – reduksiya olunmuş (GSH) və oksidləşmiş qlütation (GSSG). Reduksiya olunmuş qlütation (GSH)əhəmiyyətli antioksidant kimi təsir göstərir və sərbəst radikalları aktiv şəkildə neytrallaşdırır. Oksidləşmiş qlütation (GSSG) isə bir GSH ilədigər GSH molekulunun qlütationperoksidaza fermentinin iştirakı ilə birləşməsi nəticəsində yaranır. Adətən, hüceyrələrdə olan qlütationun 90%-ni reduksiya olunmuş forma (GSH) və 10%-ni isə oksidləşmiş forma (GSSG) təşkil edir ki, o, da qlütationreduktaza fermenti təsirindən reduksiya olunmuş qlütationa çevrilə bilir. Oksidativ stress zamanı reduksiya olunmuş GSH bu prosesə sərf olunduğundan hüceyrələrdə oksidləşmiş qlütationun miqdarı reduksiya olunmuş qlütationa nisbətən artıq olur.
Tədqiqatlar nəticəsində müəyyən edilmişdir ki, ksenobiotiklərin orqanlara– böyrək, qaraciyər, sinir və ürək-damar sisteminə zərərli təsirlərinin yaranması mexanizmi oksidativ stress ilə əlaqədardır. Qeyri-steroid iltihab əleyhinə dərman preparatlarının, xərçəng zamanı istifadə edilən kimya terapiyanın, antipsixotik təsirli preparatların toksiklikləri oksidativ stress yaratmaları ilə əlaqələndirilir. Dərman preparatlarının oksidativ stress yaratma mexanizmləri fərqlidir. Bəzi preparatlar molekulyar oksigeni reduksiya etməklə oksigenin sinqlet oksigen və superoksid kimi aktiv formalarını əmələ gətirən reaktiv aralıq məhsullar yaradırlar, digərləri isə birbaşa hüceyrələrdə oksigenin aktiv formalarının miqdarının artmasını stimullaşdırırlar [4].
ANTİOKSİDANTLAR
Antioksidantlar qida məhsullarında və insan orqanizmində rast gəlinən və aşağı qatılıqda tapılan maddələrdir[5]. Onlar orqanizmdə baş verən oksidləşmə proseslərinə nəzarət edir və ehtiyac yarandıqda bu reaksiyaları inhibə edirlər. Antioksidantlar elektron donoru xassəsinə malikkimyəvi birləşmələrdir. Onlar sərbəst radikalların patoloji təsirini zərərsizləşdirir və insan orqanizminin müdafiəsini həyata keçirirlər. Antioksidantlar elektron verdikdən sonra özləri sərbəst radikala çevrilmirlər və stabilvəziyyətdə qalırlar.
Antioksidant xassəyə malik molekullar orqanizmdə endogen yolla yarana bilər və ya xaricdən qida məhsulları ilə ekzogenyol ilə daxil ola bilərlər. Antioksidant xassəli əsas fermentlərə superoksid dismutaza (SOD – Superoxyde Dismutase), catalaza (CAT – Catalase) və qlütation peroksidaza (GSH-Px – Glutathion Peroxydase) aid edilir. SOD superoksid anionu CAT vəGSH-Px üçün substrat olan hidrogen peroksidə (H2O2) çevirir. Katalaza H2O2-ni suya və oksigenə metabolizmə uğradır, GSH-Px isə H2O2-ni və eləcə də üzvi hidroperoksidləri GSH ilə reaksiya vasitəsilə reduksiya edir.Həmçinin, metallarla birləşmə əmələ gətirən zülallar (ferritin, laktoferrin, albumin), tiol qrupu saxlayan aminturşular (sistein), ubixinol, lipoy turşusu, sidik turşusu, superoksidreduktaza və s. antioksidant xassəyə malikdirlər.
Ekzogen antioksidantlara vitaminlər (A, E, C), makro- və mikroelementlər (selen, mis, sink, maqnezium), karotinoidlər (beta-karotin, likopin, beta-kriptoksantin), stilbenlər (rezveratrol), polifenollar, flavonoidlər, taninlər, kumarinlər, antosianlar, liqnanlar və s. aiddir. Ekzogen antioksidantlardan sayılan E və C vitaminləri orqanizmin hüceyrə zarlarında (membranlarında), həmçinin hüceyrə xarici və hüceyrə daxili mayelərdə rast gəlinir. Onlar ROS ilə reaksiyaya girərək sonuncuları inhibə edir və ya neytrallaşdırırlar. Membranların daxili hidrofob lipid sahələrinə müxtəlif antioksidantlar təsir edirlər. Yağlarda həll olan E vitamini bu mühit üçün çox əhəmiyyətli antioksidantdır və membranın tamlığının qorunmasını təmin edir.
Yağlarda həll olan antioksidantlar bioloji membranlarda polidoymamış yağ turşularının peroksid oksidləşməsinin qarşısının alınmasında böyük əhəmiyyətə malikdirlər. Suda həll olan antioksidantların (C vitamini) hidrofil mühitdə ROS-un neytrallaşdırılmasında müstəsna əhəmiyyətləri vardır.
1. Antioksidant fəallığın yoxlanılması. Kimyəvi birləşmələrin antioksidant fəallığının qiymətləndirilməsi üçün spektrometrik, elektrokimyəvi analiz və s.üsullardan istifadə edilir [6]. Spektrometrik üsullara oksigen radikalı udma bacarığı (ORAC–Oxygen Radical Absorption Capacity), hidroksilradikalı antioksidantlıq bacarığı (HORAC–Hydroxyl Radical Antioxidant Capacity), ümumi peroksid radikal tutma antioksidant parametri(TRAP – Total Peroxyl Radical Trapping Antioxidant Parameter), misireduksiyaedici (misin reduksiyası) antioksidant qüvvə (CUPRAC – Cupric Reducing Antioxidant Power), dəmiri reduksiyaedici (dəmirin reduksiyası) antioksidant qüvvə (FRAP – Ferric Reducing Antioxidant Power), kalium-ferrisianidi reduksiyaedici (kalium-ferrisianidin reduksiyası)qüvvə (PFRAP – Potassium Ferricyanide Reducing Power), 2,2′-Azinobis- (3-etilbenzotiazolin-6-sulfon turşusu (ABTS), difenil pirilhidrazil radikal (DPPH – [2,2-di (4-tert-octylphenyl)-1-picrylhydrazyl]və flüorimetrik analiz aiddir. Elektrokimyəvi analiz üsullarına voltammetriya, amperometriya və biamperometriya aid edilir.
Spektrometrik üsullarla təyinatın mexanizmində kimyəvi reaksiya nəticəsində baş verən dəyişikliyin qeyd edilməsi dayanır. Kimyəvi reaksiyaların aparılması iki prosesə əsaslanır: hidrogen atomu ötürülməsi (HAT –hydrogen atom transfer) və tək elektronun ötürülməsi (SET– single electron transfer).
Hər hansı bir üsulun istifadəsi ilə əldə edilən nəticələrin dürüstlüyünün müəyyənləşdirilməsi üçün alınan nəticələrin statistik işləmələri yerinə yetirilir.
2. Hidrogen atomunun ötürülməsinə əsaslanan testlər (HAT). Antioksidant aktivliyin HAT mexanizmini fenolun (Ar-OH) hidrogen atomunun (H) peroksid radikala ötürülməsi reaksiyası təşkil edir:
ROO● + AH/Ar-OH ⇄ ROOH + A● /ArO●
burada, fenol (Ar-OH) ilə peroksid radikalın (ROO●) reaksiyası nəticəsində yaranan ariloksil radikal (ArO●) rezonansla stabilləşir, AH isə qorunan biomolekullardır.
HAT-əsaslı testlərin tipik nümunələri kimi oksigen radikalı udma bacarığı (ORAC),ümumi peroksid radikal tutma antioksidant parametri (TRAP) və ümumi oksiradikal tutma bacarığı (TOSC –Total Oxyradical Scavenging Capacity) sınaqlarıdır.
2.1. ORAC testi. Antioksidant aktivliyin təyin edilməsində istifadə olunan geniş yayılmış sınaqdır. İlk dəfə Q.Kao tərəfindən təklif edilmişdir. ORAC testlər peroksid radikalın oksidləşməsinin qarşısının alınmasına nəzarət etməklə antioksidantlar tərəfindən radikal zəncirvari reaksiyanın parçalanma qabiliyyətini ölçür. Peroksid radikallar bioloji sistemlərdə lipidlərin oksidləşməsi zamanı, həmçinin fizioloji şəraitdə qida məhsullarında üstünlük təşkil edir və sərbəst radikallar kimi xarakterizə olunur. ORAC sınaqlar antioksidant effektivliyi üçün bir meyar kimi dəyərləndirilir.
Bu analizdə istifadə edilən peroksid radikal generatorlarını azobirləşmələr təşkil edir. Bu azobirləşmələrə lipofil α,α,-azobisizobutironitril (AIBN), 2,2-azobis(2-amidinpropan) xlorhidrat (ABAP), 2,2′-azobis(2,4-dimetilvaleronitril) (AMVN) və hidrofil 2,2′-azobis(2-amidinpropan) dihidroxhlorid (AAPH) aid edilir.
ORAC testinin mexanizmi flüoressensiyanın intensivliyinin reaksiyanın getmə müddətindən asılılığını ölçməyə əsaslanır. ORAC testinə əsasən generator tərəfindən emissiya edilən peroksid radikal flüoressent nümunə ilə reaksiyaya daxil olur, bu zaman onun flüoressensiyasının itməsi baş verir ki, proses flüorimetrdə qeydə alınır. Bu üsulda antioksidantın mövcud olub olmamasına əsasən kalibrə qrafikində əyrialtı sahə ölçülür. Antioksidant aktivliyin miqdarca qiymətləndirilməsi antioksidant mövcudluğu və yoxluğu iləəldə olunan iki əyrialtı sahənin ölçülməsi ilə yerinə yetirilir. Etalon kimi adətən troloks antioksidant standartından istifadə edilir və antioksidantlar tərəfindən qiymətləndirilən ORAC göstəricisi troloksun ekvivalenti kimi təsvir edilir. Troloks E vitamininin suda həll olan analoqudur (Şək. 2).
Çox zaman hidroksil radikalı generatoru kimi H2O2-CuSO4 sistemi, β-fikoeritrin isə zülalın oksidləşmə-reduksiya flüorosent indikatoru kimi istifadə edilir ki, onun da flüoressensiya zamanı parçalanması sərbəst radikal tutucuları iştirakında ölçülür. Bu zaman standart kimi troloks tətbiq edilir. Kompleks əmələgəlmə (Cu (II) + H2O2) reaksiyasının başlanğıcında mis (II) hidroperoksid (CuOOH+) yaranır ki, sonrakı mərhələdə reaksiya zəif sürətlə getməklə Cu (I) və O2- əmələ gəlir. Hidrogen atomu donorlarının iştirak etmədiyi şəraitdə Cu-O rabitəsinin hemolitik qırılması CuOOH+birləşməsinin parçalanması üstünlüyü ilə baş verir. Növbəti reaksiyada Cu (I) H2O2ilə reaksiyaya daxil olur və sərbəst hidroksil radikalı HO● əmələ gəlir (Şək. 3).
Flüoressensiyanın ölçülməsi 515 nm dalğa uzunluğunda yerinə yetirilir. Həyəcanlandırma dalğa uzunluğu 485 nm seçilir. Flüoressensiyanın intensivliyi 35 dəqiqə ərzində hər 1 dəqiqədən bir ölçülür. Ölçmə həm antioksidant iştirakı və həm də antioksidantsız aparılır. Ümumi ölçmə müddəti 70 dəqiqə davam edir. Hər analizin nəticəsi kalibrə qrafikinə görə hesablanır və maddənin mkmol/qr quru qalığına əsasən aparılır (Şək. 4).
Beləliklə, AAPH-ın (R-N=N-R) termo parçalanması nəticəsində alkil radikal R● molekulyar oksigenlə O2 birləşərək peroksid radikalın ROO●yaranmasını təşviq edir. Burada peroksid radikalın əmələ gəlməsi temperaturdan çox asılı olduğu üçün analizin gedişi zamanı temperatur fərqinin yaranmaması nəzarətdə saxlanılmalıdır.
ORAC testinin tətbiqinin ilk illərində flüoressent nümunə kimi Porphyridium cruentum-dan alınmış β-fikoeritrin zülalından istifadə edilirdi. Lakin β-fikoeritrinin bəzi çatmayan cəhətlərinə görə bəzi tədqiqatçılar onu flüoressein, Nil göy fosforu, p-aminbenzoy turşusu və digər maddələr ilə əvəzləməyə üstünlük verirlər.
Beləliklə, ORAC testinin mexanizmi aşağıdakı kimi izah olunur. Azobirləşmələr qızdırıldıqda əmələ gələn ROO● radikalının flüoressent molekulunu zədələməsi nəticəsində flüoressensiyanın itməsi müşahidə olunur. Oksidləşməklə parçalanma davam etdikcə flüoressensiyanın zəifləməsi də davam edir. Lakin antioksidantlar flüoressent molekulunu oksidləşməklə zədələnmədən müdafiə edərək qoruyurlar. Müdafiə dərəcəsi miqdarca flüorometr tərəfindən ölçülür.
ORAC testi qida maddələrinin (çay, meyvə, tərəvəz, bitki ekstraktları, melatonin, dofamin, flavonoid və s.) antioksidant aktivliyinin yoxlanılmasında geniş istifadə edilir. Qeyd etmək lazımdır ki, ABŞ-da qida maddələrinin antioksidant aktivliyin əsasında yaradılan bank məlumatları ORAC üsulu nəticələri ilə hazırlanır.
2.2. HORAC testi. Bu test Cu (II) kompleksin hidroksil radikalın yaranmasından qorunma üçün müdafiə qabiliyyətinin dəyərləndirilməsini ölçür. Tədqiq edilən nümunə flüoressein ilə inkubasiya edilir, sonra üzərinə Fenton qarışığı (hidroksil radikalı generatoru) əlavə edilir. Başlanğıc flüoressensiya və sonrakı qarışdırılma zamanı hər dəqiqədəki flüoressensiya ölçülür. Kalibrə əyrisinin qurulması üçün standart kimi qall turşusunun müxtəlif qatılıqlı məhlullarından istifadə edilir. HORAC testi hidroksil radikallara qarşı antioksidant aktivliyin radikal reaksiyaların qırılması yolu ilə birbaşa ölçülməsini təmin edir.
2.3. TRAP testi. Bu sınaq antioksidantların hədəf molekul ilə peroksid radikallar arasında gedən reaksiyanı inhibə etmək qabiliyyətinin ölçülməsinə əsaslanır. Hədəf molekul 2,2-azobis(2-amidinpropan) dixlorid ABAP-ın termik parçalanması nəticəsində baş verən peroksid oksidləşmə zamanı əvvəlcə özünü O2 uducu kimi (nümunə şəklində) göstərir. Molekulyar oksigenin O2 udulma müddətində müşahidə olunan gecikmələr, yəni induksiya dövrü miqdarca ölçülə və nümunənin ümumi antioksidant göstəricisi TRAP parametrini ifadə edə bilər. TRAP indeksi bir litr mayedə (plazmada) olan ROO● radikalının mollarının sayına əsasən aşağıdakı düsturla hesablanır:
TRAP = RROO● x τplazma
burada, RROO● – ROO●-nun yaranma sürəti, τplazma– insan plazması iştirakı ilə yaranan oksigenin istehlakında gecikmə müddətidir.
3. Tək elektronun ötürülməsi testləri (SET). Tək elektronun ötürülməsi testləri, həmçinin elektron transferi (ET) testləri də adlandırılır.Bu testlər sərbəst radikalların, karbonil qrupunun və metalların reduksiyası məqsədi ilə antioksidantın elektron ötürmə qabiliyyətinin ölçülməsinə əsaslanır. SET testlərinin antioksidant təsirini aşağıdakı reaksiyalar kimi təsvir etmək olar:
ROO• + AH/ArOH → ROO− + AH•+/ArOH•+
AH•+/ArOH•+ + H2O ↔ A•/ArO• + H3O+
ROO− + H3O+ ↔ ROOH + H2O
Folin-Çiokalto, dəmiri reduksiyaedici antioksidant qüvvə(FRAP) və misi reduksiyaedici antioksidant qüvvə (CUPRAC) daxil olmaqla SET spektroskopik testləri oksidləşdiricinin reduksiya edilməsi üçün antioksidant qabiliyyətinin ölçülməsinə əsaslanır ki, bu zaman azalma davam etdikcə rəng dəyişməsi müşahidə olunur. Rəngin dəyişmə dərəcəsi ümumi antioksidantın miqdarı ilə korrelyasiya olunur.
3.1. CUPRAC testləri. Ümumi antioksidant qabiliyyətinin ölçülməsi üçün istifadə edilən CUPRAC testlərinin ilkin variantı 2000-ci ildə təklif edilmişdir. Lakin sonradan müxtəlif antioksidant aktivliyin ölçülməsi üçün bir qədər təkmilləşdirilmişdir. Sınaq Cu2+ ionlarının Cu+ ionlarına reduksiyasına əsaslanır. Digər üsullarda olduğu kimi optik sıxlığın ölçülməsinin asanlaşdırılması məqsədi ilə mis-liqand kompleksi almaq üçün liqanddan istifadə edilir. Liqand qismində neokuproin (Nc; 2,9-dimetil-1,10-fenantrolin) tətbiq edilir. Bu üsul həm lipofil və həm də hidrofil maddələrin antioksidant xüsusiyyətlərinin ölçülməsi üçün yararlıdır.
CUPRAC testlərindən qida maddələrinin antioksidantlıq xassələrinin öyrənilmsəində geniş istifadə edilir. Testlər qida komponentərinin Cu2+– neokuproin reaktivinin xromogen oksidləşdirici xüsusiyyətlərinə əsaslanır ki, nəticədə Cu2+ vəziyyətdən Cu+ vəziyyətə keçir. Mis ionlarının Cu2+reduksiyaedicineokuproin iştirakı ilə reduksiyası 450 nm maksimum udma verən kompleks əmələ gətirir.CUPRAC sınağının xromogen oksidləşdirici reaktivi Cu2+–Nc reduksiyaedici antioksidant substansiyanın (AOX)n-elektronları ilə reaksiyaya daxil olur (şək. 5 və 6):
Bu reduksiya reaksiyasında polifenol və digər antioksidantların Ar-OH qrupları müvafiq xinonlara oksidləşirlər, Cu2+-neokuproin kompleksi isə sarı-narıncı rəngli Cu+-neokuproin kompleksinə qədər reduksiya olunur.
Bir çox spesifik maddələrin, o cümlədən rozmarin turşusu, epikatexin- qallat, kversetin, katexin, kofein turşusu, epikatexin, qall turşusu, rutin, xlorgen turşusu və s. üçün CUPRAC testləri maddələrin antioksidant fəallıqlarının ölçülməsində ən yaxşı sınaqlar kimi özünü doğrultmuşdur [7].
3.2. FRAP testlər. FRAP sınaqları Fe (III)-tripiridil triazin kompleksinin aşağı pH (pH = 3.6) göstəricilərində Fe (II) kompleksinə çevrilməsi ilə xarakterizə edilir. Belə reduksiya prosesi 593 nm dalğa uzunluğunda udulmanın ölçülməsi ilə aparılır. Reaksiyanın aparılması üçün 3 ml işçi reaktiv məhlulu hazırlanır, onun üzərinə tədqiq edilən durulaşdırılmış nümunə məhlulundan 100-150 mkl əlavə edilir. Termostatda 37 °C temperaturda 30 dəqiqə saxladıqdan sonra 593 nm dalğa uzunluğunda udulma ölçülür.
FRAP testlərində gedən reaksiya aşağıdakı şəkildə gedir. Rəngsiz məhlul intensiv göy rəngə çevrilir (şək.7):
Bu testlər bioloji mayelərin, qida maddələrinin, bitki ekstraktlarının və s. antioksidant fəallıqlarının müəyyənləşdirilməsi üçün istifadə edilir. Lakin molekulunda tiol qrupu olan birləşmələr üçün istifadə oluna bilmir.
3.3. Folin – Çiokalto üsulu. Folin – Çiokaltotestləri ümumi fenol tərkibinin öyrənilməsi üçün tətbiq edilir. Bu sınaqlar bitki mənşəli qidalarda və bioloji nümunələrdə ümumi polifenol tərkibin öyrənilməsi üçün istifadə edilmişdir.
Folin – Çiokalto sınağının mahiyyəti Folin – Çiokalto reaktivinin (fosformolibden/fosforvolfram turşusu) qələvi mühitdə fenol birləşmələri tərəfindən reduksiya olunmasına əsaslanır. Bu zaman ilkin sarı rəngli məhlul göy rəngli məhlula çevrilir və onun optik sıxlığı 765 nm dalğa uzunluğunda ölçülür.
4. Qarışıq sınaqlar (HAT/SET). Bu sınaqlar reaksiyanın getmə şəraitindən asılı olaraq (mühitin pH göstəricisi, həlledicinin təbiəti) hidrogenin və tək elektronun ötürülməsi müxtəlif nisbətlərdə baş verir. Bu sınaqlara ABTS, DPPH və s. aiddir.
4.1. ABTS (TEAC) testləri. ABTS testləri 1993-cü ildə N.Miller və onun komandası tərəfindən təklif edilmişdir. Bu testlər antioksidant təsirindən 2,2′-azinbis(3- etilbenztiazolin-6-sulfon turşusu) (ABTS•+) kation-radikalın rənginin dəyişmə dərəcəsini ölçməyə əsaslanır. Tədqiqatlar reaksiya nəticəsində əmələ gələn göy-yaşıl məhlulun rəng intensivliyinin azalmasının 734 nm dalğa uzunluğunda optik sıxlığının ölçülməsi ilə yerinə yetirilir. ABTS testləri tətbiqində alınan nəticələr troloksa nisbətdə mmol/kq və ya mmol/litr ilə ifadə olunur (şək.8).
4.2. DPPH testləri. Bu sınaq ilk dəfə 1922-ci ildə Qoldsmit və Renn tərəfindən təklif edilmişdir. DPPH• (2,2-di(4-tert-oktilfenil)-1-pikrilhidrazil) π-radikaldır və udma sahəsi 517 nm dalğa uzunluğuna uyğundur. Bu üsulun tətbiqi DPPH-in ilkin qatılığının azalması üçün zəruri olan antioksidantın miqdarının spektrofotometriya ilə ölçülməsinə əsaslanır.
Bu zaman qeyd edilən prosesin getməsi üçün tələb olunan zaman qeyd edilir. Reaksiyanın gedişində DPPHmolekulundakı azot atomunun tək elektronunun antioksidantdan hidrogen atomunu qəbul etməklə müvafiq hidrazinə reduksiya olunması baş verir. DPPH• radikalı stabil və intensiv bənövşəyi rəngə malikdir. Radikalın stabilliyi birinci dərəcəli ikivalentli azot atomunun sterik sıxlığı və elektron donoru rolunu daşıyan ikinci dərəcəli difenilamin qrupu və elektron akseptoru olan pikril tərəfindən həyata keçirilən “özünə çək-itələ” effekti ilə əlaqədardır. Belə təsir molekulun kanonik quruluşunu əhəmiyyətli dərəcədə sabitləşdirir. Qeyd edilir ki, DPPH• radikalının UB spektrində meydana çıxan iki ayrı zolaq π-π* keçidi nəticəsində yaranır və qoşalaşmamış elektron görünən sahədə zolağa təsir edir. Təyinat zamanı DPPH məhlulu özündən hidrogen atomu verə bilmə qabiliyyətinə malik maddə məhlulu ilə qarışdırılarkən bənövşəyi rəng itir və DPPH radikalının reduksiya olunmuş forması (DPPH-H) əmələ gəlir (şək.9). Spektrdə daha geniş zolaq DPPH• radikalı məhlulunun dərin bənövşəyi rənginə uyğundur. Hidrazinin (DPPH-H) əmələ gəlməsi ilə H donoru olan antioksidant molekulundan hidrogen atomunun köçürülməsi nəticəsində məhlulun rəngi bənövşəyidən açıq sarı rəngə qədər dəyişir və görünən zolaq yox olur. Reaksiyanın intensivliyispektrofotometriyanın görünən sahəsindəoptik sıxlığın ölçülməsi ilə təyin edilir[8].
Radikal sudan fərqli olaraq etanol, metanol və ya onların sulu məhlulullarında həll olur. Spirtlərin sulu məhlullarında suyun miqdarı 60%-i keçməməlidir.
DPPH testi antioksidant tərəfindən DPPH•radikalın neytrallaşdırılması üçün elektronların ötürülməsinə əsaslanır. Reaksiya 517 nm dalğa uzunluğunda ölçülmüş rəngin dəyişməsi ilə müşayiət edilir ki, rəng dəyişikliyi maddənin antioksidant fəallığını qiymətləndirməyə imkan verir (şək.10).
Reaksiya aparmaq üçün hazırlanmış qarışıq qaranlıq yerdə 4°C temperaturda 60 dəqiqə saxlanılır. DPPH reaktivinin iştirakı ilə baş verən dəyişiklik, yəniaktivlik spektrofotometrdə 517 nm dalğa uzunluğunda aşağıdakı düsturla hesablanır:
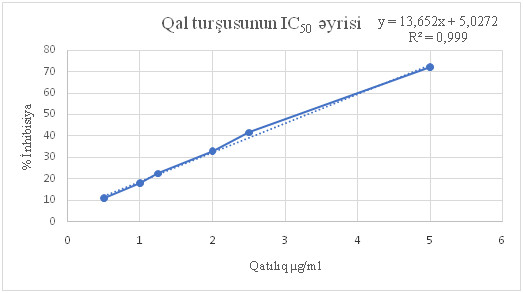
I(%) = 100 x (A0 – A1)/A0 burada, A0 – kontrol məhlulun, A1 – isə tədqiq edilən məhlulun optik sıxlığıdır. Alınan rəqəmlərə görə sərbəst radikalın 50% inhibisiyası (IC50) hesablanır. Sərbəst radikal inhibisiyası IC50göstəricisinin nə qədər az olması antioksidantlığın bir o qədər çox olmasını bildirir. IC50göstəricisi sərbəst radikalların 50%-nin inhibə olunması üçün nümunənin tələb olunduğu qatılıqdır.İnhibisiya (%) ilə qatılıq (µg/ml) arasında olan kalibrə əyrisi aşağıdakı düstur ilə hesablanır:y=ax+b
Burada, y göstəricisi IC50 göstəricisini müəyyən etmək üçün 50% ilə əvəz edilir, x isə kalibrə əyrisinə görə IC50 kəmiyyətidir, μg/ml və ppm ilə ifadə olunur. Kalibrə əyrisində korrelyasiya əmsalı dəyərinin 0.999 olması kəmiyyətlər arasında düz mütənasib asılılığı göstərir. Analiz edilən nümunənin qatılığı artdıqca antioksidantlıq da artmağa doğru gedir[9].
Alınan IC50 göstəricisinə görə antioksidant fəallıq aşağıda verilən cədvəllərdəki kimi qiymətləndirilir (cədvəl1 və 2) [10]:
Burada x-in qiymətini hesablamaqla IC50 göstəricisini müəyyən etmək mümkündür.
DPPH sınağı fərdi antioksidant molekulların və eləcə də, bitki ekstraktlarının və fenol birləşmələrin antioksidantlığının qiymətləndirilməsi üçün geniş istifadə edilir.
YEKUN
Beləliklə, ksenobiotiklərin canlı orqanizmdə oksidləşmə-reduksiya reaksiya məhsulları olan sərbəst radikalların oksidativ stress yaratması fəsadlarının qarşısının alınması üçün xaricdən antioksidant fəallıqlı maddələrin qəbul edilməsinə ehtiyac vardır. Oksidativ stress prosesinin dərinləşmədiyi hallarda gündəlik qəbul edilən qida maddələri (meyvələr, tərəvəzlər) sərbəst radikal – antioksidant tarazlığını qormağa kifayət edir. Lakin bu yolla oksidativ stresin qarşısının alınması mümkün olmadıqda orqanizmin sərəbəst radikalların zərərli təsirindən qorunması üçün antioksidant fəallıqlı maddələrin qəbul edilməsinə ehtiyac yaranır. Qəbul edilən bioloji fəal maddələrin antioksidant fəallıq göstəricilərinin əvvəlcədən təyin edilməsi onların hansı patoloji hallarda və hansı dozada təyin edilməsini müəyyən edir. Kimyəvi maddələrin antioksidant fəallıqlarının ölçülməsi müxtəlif sınaqlardan (ORAC, HORAC, TRAP, CUPRAC, FRAP, Folin – Çiokalto, ABTS (TEAC) və DPPH testləri) istifadə etməklə yerinə yetirilir.
Figures

Keywords
References
1. Hayrullah K., Mehmet Ş.G.Serbest Radikaller// MAKÜ Sag. Bil. Enst. Derg. 2016, No. 4(1), s.:50-59
2. Lien A.Ph., Hua H., Chuong Ph. Free Radicals, Antioxidants in Disease and Health //Int J Biomed Sci. 2008, No. 4(2), p.:89-96.
3. Меньшикова Е.Б., Ланкин В.З., Кандалинцева Н.В. Фенольные антиоксиданты в биологии и медицине. Строение, свойства, механизмы действия: монография /Saarbrücken: LAP LAMBERT Academic Publishing, 2012, 496 с.
4. Said E., Metwally E.A., Ahmed M.M. Role of Natural Antioxidants in Treatment of Toxicity // Journal of Toxicological Analysis 2018, Vol.1, No. 1(3), p. 1-8.
5. Яшин А.Я. Методология определения антиоксидантной активности пищевых продуктов и биологических жидкостей // Аналитика,2021,Том 11, №5, с.: 370-384
6. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8037236/
7. Munteanu I.G., Apetrei C. Analytical Methods Used in Determining Antioxidant Activity: A Review //Intern. Journal of Molecular Sciences. 2021,No. 22(7), p.:3380; doi: 10.3390/ijms22073380
8. Gulcin I., Alwasel S.H. DPPH Radical Scavenging Assay// Processes 2023, No.11(8), p.: 2248 (https://doi.org/10.3390/ pr11082248)
9. Breaud C., Lallemand L., Mares G., Mabrouki F., Bertolotti M., Simmler C., Greff S., Mauduit M., Herbette G., Garayev E.A. and ets. LC-MS Based Phytochemical Profiling towards the Identification of Antioxidant Markers in Some Endemic Aloe Species from Mascarene Islands // Antioxidants 2022, No. 12(1), p.: 50; doi.org/10.3390/antiox12010050
10. Phongpaichit S., Nikom J., Rungjindamai N., Sakayaroj J., Hutadilok N., Rukachaisirikul V. and Kirtikara K. Biological activities of extracts from endophytic fungi isolated from Garcinia plants//FEMS Immunol. Med. Microbiol., 2007, No.51(3), p.:517-525; doi:10.1111/j.1574-695X.2007.00331.x.
Article Info:
Publication history
Published: 30.Apr.2025
Copyright
© 2022-2025. Azerbaijan Medical University. E-Journal is published by "Uptodate in Medicine" health sciences publishing. All rights reserved.Related Articles
Viewed: 1299



